Der Taschenwärmer - Beispiel eines Alltagsphänomens für den Phasenübergang Schmelzen und Erstarren
| Der Taschenwärmer - Beispiel eines Alltagsphänomens für den Phasenübergang Schmelzen und Erstarren | |
 Titelbild: Aufbau zur Untersuchung des Taschenwärmers | |
| Kurzbeschreibung | |
|---|---|
| Am Beispiel des Taschenwärmers soll der Zusammenhang zwischen Aggregatzustandsänderungen und der Zufuhr oder Abgabe von Wärmeenergie untersucht, formuliert und vertieft werden. | |
| Kategorien | |
| Thermodynamik | |
| Einordnung in den Lehrplan | |
| Geeignet für: | Klasse 7, Klasse 8 |
| Basiskonzept: | Materie, Energie |
| Sonstiges | |
| Durchführungsform | Demoexperiment, Schüler*innen-Experiment, Gruppenexperiment |
| Anzahl Experimente in dieser Unterkategorie | 2 |
| Anspruch des Aufbaus | leicht |
| Informationen | |
| Name: | Athina Papakonstantinou |
| Kontakt: | @ |
| Uni: | Humboldt-Universität zu Berlin |
| Betreuer*in: | Björn Leder |
In der kalten Jahreszeit ist in den letzten Jahren der Taschenwärmer (auch Knickwärmer oder Handwärmer genannt) in Mode gekommen und ist mittlerweile in vielen unterschiedlichen Formen und mit verschiedenen Motiven preisgünstig erhältlich. Auch wenn der Taschenwärmer nicht mehr brandneu ist, fasziniert sein Effekt nach wie vor:
In einer Kunststoffumhüllung befindet sich ein flüssiger Stoff (in der Regel ist dies Natriumacetat-Trihydrat) und ein Metallblättchen, das sich knicken lässt, wodurch die Flüssigkeit plötzlich erstarrt und warm wird. Damit kann man dann zum Beispiel seine Hände wärmen. Nach geraumer Zeit kühlt der Stoff ab, bleibt dabei aber fest. Erwärmt man dann den Taschenwärmer in einem Topf mit heißem Wasser, verflüssigt sich der Stoff wieder und nach erneuter Abkühlung bleibt er in flüssigem Zustand, so lange, bis erneut das Metallblättchen geknickt wird und der Prozess von neuem beginnt. Dieses Prinzip ist das eines Latentwärmespeichers.
Die Faszination des Effekts des Alltagsphänomens Taschenwärmer soll für die Unterrichtseinheit zum Phasenübergang Schmelzen und Erstarren genutzt werden, um den Zusammenhang zwischen Aggregatzustandsänderungen und der Zufuhr oder Abgabe von Wärmeenergie zu untersuchen, zu formulieren und zu vertiefen. Dadurch soll die Funktionsweise des Taschenwärmers phänomenologisch betrachtet, untersucht und begreifbar gemacht werden.
Inhaltsverzeichnis
Didaktischer Teil
Theoretischer Hintergrund, Voraussetzungen und Begriffliches
Führt man einem festen Stoff bei konstantem Druck eine konstante Wärmeleistung zu, erhöht sich die kinetische Energie und die Temperatur steigt an bis zu einer gewissen Temperatur - der Schmelztemperatur. Während des Schmelzvorgangs erfolgt dann keine Temperaturänderung mehr, die kinetische Energie bleibt konstant, die Energiezufuhr bewirkt die Erhöhung der potentiellen Energie der Moleküle, d.h. mit dem Teilchenmodell betrachtet können die Moleküle ihren festen Platz (Ruhelage) verlassen, ihre Abstände werden größer und damit die anziehenden Kräfte geringer. Dadurch tritt eine Strukturänderung des Stoffes ein, er wird flüssig. Nach Beendigung des Schmelzvorgangs steigt dann bei weiterer Energiezufuhr die Temperatur weiter an. In der Regel ist dieser Vorgang umkehrbar. Kühlt man eine Flüssigkeit ab, so wird ihr Wärmeenergie entzogen, die Temperatur sinkt so lange, bis die Erstarrungstemperatur erreicht wird, deren Betrag dem der Schmelztemperatur entspricht. Während des Erstarrungsvorgangs wird Wärmeenergie abgegeben, die Temperatur bleibt aber wieder konstant. Diese Energie wird Erstarrungsenergie, Erstarrungswärme oder auch latente Wärme genannt. Sie entspricht der Schmelzenergie (auch Schmelzwärme genannt), die beim Schmelzvorgang zugeführt wurde. Diese Energie ist stoffabhängig.
Beim Erstarren kommt es bei vielen Stoffen zur Kristallisation. Sie benötigen zum Erstarren einen Auslöser, einen sogenannten Kristallisationskeim. Ist dieser nicht vorhanden, kühlt die Flüssigkeit unterhalb der Schmelz- bzw. Erstarrungstemperatur ab, ohne sich zu verfestigen. Es entsteht eine sogenannte unterkühlte Flüssigkeit. Wird dann die Kristallisation ausgelöst (z.B. durch Erschütterung, Kristallzugabe etc.) erfolgt der Erstarrungsprozess schlagartig, die Erstarrungsenergie wird frei und die Temperatur steigt auf die Erstarrungstemperatur an. Auf diesem Effekt basiert die Funktionsweise des Taschenwärmers.
Man kann dieses Prinzip zum Beispiel an Wasser verdeutlichen. Wasser gefriert bekanntlich bei 0°C. Führt man einen Versuch im Schullabor durch, um festzustellen, dass die Temperatur während des Erstarrungsvorgangs konstant bleibt, wird dem Wasser meistens zum Vorkühlen schon Eis hinzugefügt und zudem soll immer wieder umgerührt werden, um eine gleichmäßige Temperaturverteilung zu erhalten (Versuch "V 7.2.1 2 Die Erstarrungstemperatur des Wassers", vgl. Dahncke[1] (1986), S. 188). Unter diesen Voraussetzungen beobachtet man tatsächlich, dass während des Gefrierens des Wassers die Temperatur konstant um die 0°C liegt. Kühlt man dagegen Wasser ab, ohne es rühren oder zu verunreinigen, kann man den Effekt der Unterkühlung (theoretisch unbegrenzt, praktisch ist liegt die Unterkühlungstemperatur meist zwischen -3°C bis -7°C) und der frei werdenden Erstarrungsenergie beobachten, wonach die Temperatur beim Erstarren auf etwa 0°C steigt (Versuch "V 7.2.1 10 Die Erstarrungswärme", vgl. Dahncke[1] (1986), S. 196).
Bei dem Inhalt des Taschenwärmers handelt es sich in der Regel um eine übersättigte Lösung von Natriumacetat-Trihydrat. Das Verflüssigen sollte daher eher Lösen statt Schmelzen heißen und die Schmelzenergie sollte als Lösungswärme bzw. -energie bezeichnet werden. Durch die Kristallisation beim Erstarren wird oft von Kristallisationswärme gesprochen anstatt von Erstarrungswärme bzw. -energie. Da bei diesem Experiment zunächst von einer unbekannten Substanz ausgegangen wird, werden auch weiterhin die allgemeinen Begriffe Schmelzen und Erstarren verwendet.
Didaktische Einordnung
Die Faszination des Effekts des Alltagsphänomens Taschenwärmer soll genutzt werden, um das Thema Phasenübergänge im Zusammenhang mit der Abgabe oder Zufuhr von Wärmeenergie im Physikunterricht phänomenologisch zu behandeln. Durch den Alltagsbezug ergibt sich nach Muckenfuß[2](2006) ein sinnstiftender Kontext, wodurch das Interesse der Schülerinnen und Schüler geweckt wird und deren Motivation zur Auseinandersetzung mit fachlichen Inhalten gefördert wird.
Das Experiment bietet sich an, um bisherige Kenntnisse anzuwenden und zu vertiefen. Die Schülerinnen und Schüler können an einem Stoff den kompletten Phasenübergang Schmelzen und Erstarren beobachten, messen, interpretieren und diskutieren.
Anhand des Experimentes sollen Analogien und Abweichungen zu bereits bekannten Abläufen beim Phasenübergang Schmelzen und Erstarren untersucht und erkannt werden. Das Experiment kann als Anknüpfung dienen an die bisherige Erkenntnis, dass der Phasenübergang Erstarren als direkte Umkehrung des Phasenübergangs Schmelzen anzusehen ist, womit deutlich gemacht werden soll, dass der Phasenübergang Erstarren anders ablaufen kann, als unter idealisierten Bedingungen, die einen Kristallisationskeim erfordern. Auf diese Art kann die Funktionsweise des Taschenwärmers phänomenologisch erarbeitet werden. Eine parallele oder vorherige Behandlung der Unterkühlung von Wasser (Versuch zur Erstarrungswärme, siehe Abschnitt "Theoretischer Hintergrund, Voraussetzungen und Begriffliches") im Unterricht ist hier zu empfehlen.
Das Experiment lässt sich wahlweise als Demonstrationsexperiment (in verkürzter Form, siehe Abschnitt „Versuchsanleitung“) oder als Schülerexperiment durchführen. Es kann sowohl am Anfang, als auch am Ende der Unterrichtseinheit zu Aggregatszuständen stehen, die gemäß Berliner Rahmenlehrplan[3] ((2006), S. 26 f) in den Unterrichtsreihen für die Doppeljahrgansstufe 7/8 „P2 Vom inneren Aufbau der Materie“ und „P3 Wärme im Alltag, Energie ist immer dabei“ zu behandeln sind. P3 sieht im Kompetenzbereich 2 den Zusammenhang zwischen Aggregatzustandsänderungen und der Zufuhr oder Abgabe von Wärmeenergie vor, wofür sich das Experiment hervorragend eignet.
Da das Experiment leicht aufzubauen ist und sich anhand der Ergebnisse die Funktionsweise des Taschenwärmers auf den Phasenübergang Schmelzen und Erstarren zurückführen lässt, empfiehlt es sich sehr, es als Projektarbeit am Ende der Unterrichtsreihen P2 bzw. P3 gemäß Rahmenlehrplan[3]((2006), S.33) im Wahlbereich „W0 Experimentieren, protokollieren und auswerten“ vorzusehen, wo die Schülerinnen und Schüler gemäß der Bildungsstandards im Kompetenzbereich Erkenntnisgewinnung das Experiment selbstständig planen, durchführen und auswerten können. In diesem Rahmen bietet sich ein fachübergreifender Unterricht mit dem Fach Chemie an. Die Schülerinnen und Schüler können dabei sowohl zusätzlich die Natriumacetatmischung selbst herstellen und einen Taschenwärmer bauen als auch die energetischen Aspekte an einem Experiment in chemischer und physikalischer Hinsicht in Verbindung bringen.
Bezug zu anderen Vorträgen
Im Themenbereich Wärmeleitung und -ausbreitung wurden Experimente vorgestellt, durch deren Erkenntnisse ein Heizungssystem für ein Modellhaus nachempfunden werden soll. Auch dort wurde ein Alltagsgegenstand bzw. -phänomen genutzt, um das Interesse und die Motivation der Schülerinnen und Schüler zu fördern.
Im Einzelnen wurden qualitative Experimente zur Wärmeleitfähigkeit von verschiedenen Stoffen einschließlich Wasser sowie zur Absorption von Wärmestrahlung mit und ohne Isolierung durchgeführt. Dadurch sollen die Schülerinnen und Schüler erkennen und verstehen, welche Komponenten für ein Heizungssystem erforderlich sind, welche sich dafür eignen und warum. Durch die Konzeption eines Heizungssystems sollen sie dessen Funktionsweise begreifen. Ebenso wie bei dem Experiment zum Taschenwärmer wird dort ein Alltagsgegenstand in physikalischem Kontext phänomenologisch betrachtet und untersucht, wobei am Anfang das Interesse und die Motivation und am Ende die Erkenntnis und das Begreifen steht.
Versuchsanleitung
Das Experiment besteht aus zwei Teilen, dem Erwärmen und Schmelzen und dem Abkühlen und Erstarren. Der Aufbau ist jedoch identisch, beim Abkühlen wird lediglich das heiße Wasserbad und der Gasbrenner entfernt.
Aufbau
Für den Aufbau des Experiments werden die folgenden Materialien benötigt:
- (1): 1 Stativfuß
- (2): 1 Stativstange (Länge: ca. 100 cm)
- (3): 2 Stativmuffen
- (4): 2 Stativklemmen
- (5): 1 Reagenzglas 200x30mm
- (6): 1 Becherglas 250 ml
- (7): 1 Drahtnetz
- (8): 1 Dreibein
- (9): 1 Gasbrenner
- (a): 10 g fester Inhaltsstoff des Taschenwärmers (5 g für verkürzten Versuch)
- (b): 100 ml Wasser (für verkürzten Versuch heißes Wasser) + optional 100 ml Wasser
- (c): 1 Natriumacetat-Trihydrat-Kristall, alternativ 1 Glasrührstab (ohne Abbildung)
- (A): 1 Temperaturfühler NiCr-Ni (666193)
- (B): 1 Temperaturbox NiCr-Ni/NTC (524045)
- (C): 1 Sensor-CASSY (524010) mit Netzteil und USB-Kabel
- (D): 1 Laptop/PC
Alternativ zu (A) bis (D) (ohne Abbildung):
- 1 Digitalthermometer
- 1 Digitalstoppuhr
Gemäß Abb. 2 wird zunächst die Stativstange (2) im Stativfuß (1) befestigt. Als nächstes werden die beiden Stativklemmen (4) an der Stativstange mittels der zwei Stativmuffen (3) befestigt. Das Dreibein (8) wird über den Gasbrenner (9) gestellt, worauf das Drahtnetz (7) gelegt wird. Darauf wird das Becherglas (6) gestellt, welches mit 100 ml Wasser (b) befüllt ist, was als Wasserbad zur langsamen und gleichmäßigen Erwärmung dient. Das Reagenzglas (5) wird nun mit dem festen Inhalt des Taschenwärmers (a) befüllt und mit Hilfe der unteren Stativklemme so befestigt, dass sein Inhalt vollständig in das Wasserbad eingetaucht ist, das Glas jedoch nicht den Boden oder die Wände des Becherglases berührt. In der oberen Stativklemme wird der Temperaturfühler (A) befestigt. Er wird mit Hilfe der oberen Stativmuffe so weit nach unten bewegt, bis seine Spitze in die Substanz des Taschenwärmers im Reagenzglas mittig eintaucht, ohne Berührung von Wänden oder Boden des Reagenzglases. Gemäß Abb. 3 wird der Temperaturfühler (A) an die Temperaturbox (B) angeschlossen, welche an das CASSY (C) gesteckt wird. Das CASSY wird mittels USB-Kabel mit dem Laptop (D) verbunden und mit einem Netzteil an das Stromnetz angeschlossen.
Falls kein CASSY verwendet wird, ist der Versuch mit einem Digitalthermometer anstelle des Temperaturfühlers durchzuführen. Die Stoppuhr dient dann für die Ablesung der Temperatur in regelmäßigen Zeitabständen.
Durchführung
Erwärmen und Schmelzen
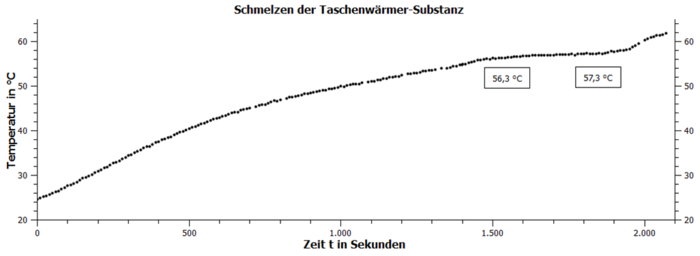
Der Gasbrenner wird angezündet und auf kleine Flamme gestellt. Dadurch wird eine langsame Erwärmung gewährleistet, wodurch der während des Schmelzvorgangs annährend konstante Temperaturverlauf sichtbar gemacht werden kann (siehe Abb. 4). Erhitzt man die Substanz zu schnell, ist das eher schwierig. Ist das CASSY angeschlossen und der Laptop angeschaltet, erkennt das Programm die angeschlossenen Module. Es ist lediglich der Eingang des Temperaturfühlers auszuwählen. Der Messvorgang kann gestartet werden. Ohne weitere Einstellungen wird nun die Temperatur T in °C pro Sekunde gemessen und graphisch dargestellt, wobei die Temperatur T in °C auf der Vertikalachse und die Zeit t in Sekunden auf der Horizontalachse dargestellt wird. Zusätzlich zu der Messung sollte beobachtet und notiert werden, bei welcher Temperatur der Schmelzvorgang beginnt und bei welcher er endet. Die Messung erfolgt so lange, bis sich die Substanz im Reagenzglas vollständig verflüssigt hat. Der Messvorgang wird dann gestoppt, der Brenner ausgeschaltet und zusammen mit dem Wasserbad vorsichtig entfernt.
Abkühlen und Erstarren
Optional kann zur Abkühlung ein Wasserbad in Zimmertemperatur vorgesehen werden, die Abkühlung erfolgt dann etwas schneller. Der Messvorgang wir erneut gestartet. Beim Abkühlen ist das Ziel, die Flüssigkeit zu unterkühlen, es sollte daher keine Störung oder Verunreinigung als Auslöser für die Kristalisation vorhanden sein. Daher ist grundsätzlich unbedingt darauf zu achten, den Aufbau nicht zu stören, also kein Stoßen, Rütteln, Schütteln oder Bewegen, selbst wenn sich am Reagenzglasrand noch einige Kristalle befinden. Solange diese die Flüssigkeit nicht berühren, stören sie auch nicht. Am besten funktioniert das Experiment, wenn man alles so lässt wie vorher. Zu beachten ist dabei noch, dass der Temperaturfühler weiterhin mittig in die Flüssigkeit eintaucht. Berührt er die Reagenzglaswand, muss nachjustiert werden, da sonst die Temperaturmessung stark verfälscht wird. Dies sollte dann unbedingt sehr vorsichtig geschehen und vor allem bei Temperaturen der Flüssigkeit über 60°C, also vor der Unterkühlung.
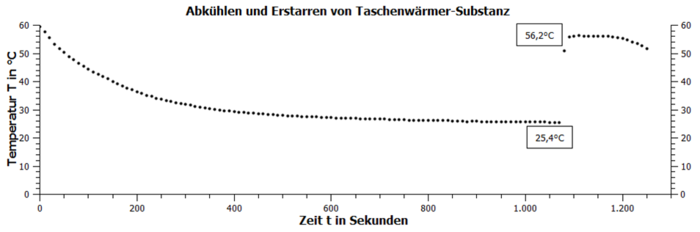
Die Temperatur der Flüssigkeit sollte nun während des Messvorgangs sinken und die Substanz sollte auch unterhalb der Schmelztemperatur flüssig bleiben. Möchte man den Effekt des Taschenwärmers vollständig nachempfinden, sollte die Abkühlung bis zur Zimmertemperatur erfolgen. Da dieser Prozess jedoch recht lange dauert und die Geduld der Schülerinnen und Schüler strapaziert, ist eine Abkühlung deutlich unterhalb der zuvor ermittelnen Schmelztemperatur ausreichend. Es sollte hier eine Abkühlung auf mindestens 45 °C stattfinden, um jedoch einen beeindruckenden Temperatursprung beobachten zu können, wird eine Abkühlung auf 30 bis 35 °C empfohlen. Ist diese Temperatur festgelegt worden und die Substanz weiterhin flüssig, wird ein Kristall (c) in das Reagenzglas geworfen. Alternativ kann man mit einem Glasrührstab in die Substanz stechen. Die Flüssigkeit sollte nun schlagartig erstarren und die Temperaturkurve sollte einen Sprung nach oben darstellen (siehe Abb. 5 und Video).
Durchführung ohne CASSY
Falls kein CASSY verwendet wird, ist der Versuch mit einem Digitalthermometer anstelle des Temperaturfühlers durchzuführen. Die Temperatur T wird dann mit Hilfe der Stoppuhr alle 30 Sekunden abgelesen und notiert. Aus den Messwerten ist dann ein Diagramm zu erstellen. In diesem Fall empfiehlt sich eine Durchführung in verkürzter Form.
Durchführung in verkürzter Form
Möchte man das Experiment als Demonstatrionsexperiment vorführen, ist es zu empfehlen, die Dauer des Experiments zu verkürzen. Eine konstante Temperatur während des Schmelzvorgangs ist dann voraussichtlich nicht gut nachzuweisen, ansonsten lassen sich alle physikalischen Aspekte zeigen bzw. feststellen. Man reduziert die Menge der Substanz aus dem Taschenwärmer um die Hälfte auf 5 g und für das Wasserbad zum Erhitzen nimmt man heißes Wasser. Die Abkühltemperatur vor dem Auslösen des Erstarrungsprozesses kann man entprechend höher wählen.
Ergänzende bzw. Alternative Vorschläge
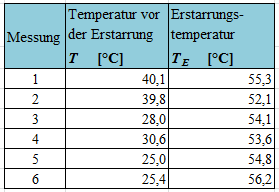
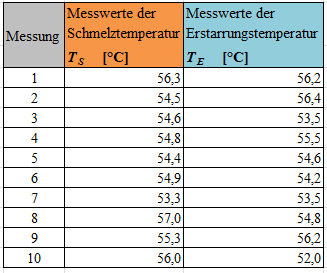
Die bisher beschriebenen Teilexperimente hatten zum Ziel, den kompletten Temperaturverlauf des Schmelz- und Abkühl- bzw. Erstarrungsvorgangs zu messen und darzustellen. Ergänzend kann man eine Messreihe starten, die mehrere Messwerte der Schmelztemperatur und der Erstarrungstemperatur aufnimmt (siehe Tab. 1), um diese zu bestimmen. Hierzu ist die Durchführung des Experiments in verkürzter Form vorzunehmen. Weiterhin kann man das Experiment so modifizieren, dass man den Erstarrungsvorgang von verschiedenen Temperaturen aus startet, um zu demonstrieren, dass die Temperatur unabhängig der vorherigen Temperatur nach dem Erstarren jeweils etwa auf die Erstarrungstemperatur ansteigt (siehe Tab. 2). Dieses Experiment lässt sich sehr gut in Gruppen durchführen, in denen jede Gruppe eine andere Ausgangstemperatur beim Auslösen des Erstarrungsvorgangs nutzt. Auch hier sollte das Experiment in verkürzter Form durchgeführt werden.
Ergebnisse
Erwärmen und Schmelzen
Die graphische Darstellung des Tempereraturverlaufs während des Schmelzvorgangs ist in Abb. 4 dargestellt. Man kann dem Diagramm entnehmen, dass über einen Zeitraum von ca. 300 Sekunden die Temperatur nahezu konstant bleibt mit einer Differenz von ca. 1°C. Während dieses Zeitraums wurde der Beginn und das Ende des Schmelzens beobachtet und notiert.
Abkühlen und Erstarren
Abb. 5 zeigt den Temperaturverlauf während des Abkühlens und des Erstarrens, welches bei ca. 25°C ausgelöst wurde.
Die schlagartige Temperaturerhöhung auf 56,2°C wird in dem Diagramm deutlich. Genau zu diesem Zeitpunkt wurde die Erstarrung der Taschenwärmersubstanz beobachtet.
Das Video zeigt das Auslösen des Erstarrungsvorgangs, welcher am oberen rechten Rand zu beobachten ist. Mittig ist die dazugehörige Temperaturkurve zu sehen.
| Video: Auslösen des Erstarrungsvorgangs |
Ergänzende bzw. Alternative Vorschläge
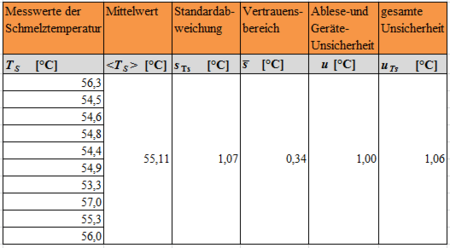
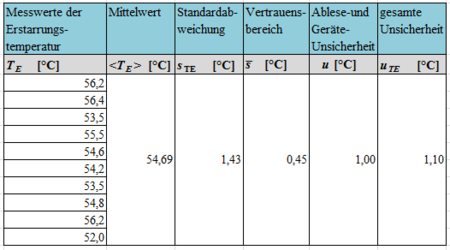
In Tab. 1 sind Messwerte zur Bestimmung der Schmelz- und Erstarrungstemperatur zusammengestellt. Für die jeweiligen Messungen sind die Experimente in verkürzter Form durchgeführt worden. Tab. 2 stellt Messergebnisse vor und nach dem Erstarren dar, die ebenso durch Experimente in verkürzter Form gemessen wurden.
Auswertung
Anhand der Grafiken der Temperaturverläufe in den Abbildungen Abb. 4 und Abb. 5 ist zusammen mit den erfolgten Beobachtungen festzustellen, dass der Schmelzvorgang unter bekannten Bedingungen mit nahezu konstanter Temperatur abläuft, die hier zwischen 56,3 und 57,3°C abzulesen ist. Daraus lässt sich auf die Aufnahme von Wärmeenergie während des Phasenübergangs schließen, z.B. in Analogie des Wassers beim Phasenübergang von fest nach flüssig. Beim Abkühlen ist zu erkennen, dass entgegen des üblichen Ablaufs keine Erstarrung der Substanz stattfindet. Das Prinzip der unterkühlten Flüssigkeit kann hier erarbeitet werden, ggf. durch zusätzliche Experimente (siehe Abschnitt "Theoretischer Hintergrund, Voraussetzungen und Begriffliches"), oder es ist bereits bekannt. Dann lässt sich hierzu die Analogie schließen und mit Hilfe eines Auslösers das Erstarren einleiten. Die Erstarrungstemperatur ist dann nach dem positiven Temperatursprung ablesbar. Die höchste Temperatur wird bei 56,2°C abgelesen. Die Erstarrungstemperatur entspricht also in etwa der Schmelztemperatur. Wie bei unterkühltem Wasser kann man hier argumentieren, dass die beim Schmelzen gespeicherte Energie beim Erstarren wieder frei wird und dadurch die Temperatur auf die Erstarrungstemperatur ansteigt.
Die Messwerte aus Tab. 2 zeigen, dass die Ausgangstemperatur beim Auslösen des Erstarrungsvorgangs keinen Einfluss auf die sich anschließend einstellende Temperatur hat. Die Temperatur scheint also unabhängig von der Ausgangstemperatur immer auf die Erstarrungstemperatur anzusteigen.
In den Tabellen Tab. 3 und Tab. 4 werden die Mittelwerte der Schmelz- und Erstarrungstemperatur aus den Messwerten (siehe Tab. 1) sowie deren Unsicherheiten ermittelt. Dazu wird als statistischer Fehler unter Annahme der Normalverteilung der Vertrauensbereich angesetzt und als system. Restfehler ein Ablesefehler von 1°C angenommen, da eine Festlegung der Schmelztemperatur, wie Abb.1 zu entnehmen ist, nicht exakt sein kann. Für die Erstarrungstemperatur wird der Fehler analog angesetzt, da die Differenz zwischen den Temperaturen innerhalb von 10 Sekunden 1°C betragen kann. Damit sollen die Schwankungen berücksichtigt werden sowie die Unsicherheit der Messgeräte abgedeckt werden, da hinsichtlich der Temperaturmessung keine Angabe des Herstellers zu finden war. Aus den Berechnungen ergibt sich eine Schmelztemperatur von TS = (55,1 ± 1,1)°C und eine Erstarrungstemperatur von
TE = (54,7 ± 1,1)°C.
Die Schmelztemperatur von Natriumacetat-Trihydrat liegt bei 58°C (vgl. Seilnacht[4]). Ein direkter Vergleich soll hier nicht gezogen werden, da nur angenommen werden kann, dass es sich bei der Substanz des Taschenwärmerinhaltes um Natriumacetat-Trihydrat handelt, tatsächlich aber nicht bekannt ist. Zumal die Ergebnisse der Schmelz- und Erstarrungstemperatur dahingehend mit der Theorie übereinstimmen, dass sie lediglich eine Differenz von 0,4°C aufweisen und damit als "gleich" betrachtet werden können. Es soll dennoch auf mögliche Fehlerquellen eingangen werden, die für die Abweichung ursächlich sein könnten. Mögliche Fehlerquellen sind:
- die tatsächliche Substanz ist nicht bekannt, sie hat ggf. minderwertige Qualität
- die Reinheit der Substanz, Verunreinigungen setzen den Schmelzpunkt herab
- eine ungleichmäßige Erwärmung/Abkühlung der Substanz, so dass die Messung der Temperatur ungleichmäßig ausfällt
- Einfluss der Umgebungstemperatur und des Luftdrucks
- Zugluft
- das Ablesen der Schmelztemperatur zum richtigen Zeitpunkt (vorallem bei der verkürzten Durchführung)
- der Temperaturfühler befindet sich zu nahe am Glasrand.
Sicherheitshinweise
- Beim Arbeiten mit dem Gasbrenner ist stets Vorsicht geboten, es herrscht Verbrennungsgefahr! Lange Haare sollten zusammengebunden werden.
- Natriumacetat bzw. Natriumacetat-Trihydrat ist ungiftig und nicht gesundheitsschädlich. Es ist das Salz der Essigsäure, womit auch Lebensmittel konserviert werden. Es sollte aber trotzdem nicht verzehrt werden und die Hände sollten nach der Berührung gewaschen werden. Diese Vorsicht ist vorallem dann geboten, wenn der Inhalt des Taschenwärmers nicht bekannt bzw. deklariert ist.
Literatur
- ↑ 1,0 1,1 Dahncke, H., Götz, R., Langensiepen, F. (1986): Handbuch des Physikunterrichts. Sekundarbereich 1. Band 3. Wärmelehre/Wetterkunde. Aulis Verlag Deubner & Co.KG. Köln
- ↑ Muckenfuß, H. (2006): Lernen im sinnstiftenden Kontext. Entwurf einer zeitgemäßen Didaktik des Physikunterrichts. Cornelsen. Berlin
- ↑ 3,0 3,1 Berliner Rahmenlehrplan Physik für die Sekundarstufe I, Jahrgangsstufe 7-10. Verfügbar unter https://www.berlin.de/sen/bildung/unterricht/faecher-rahmenlehrplaene/rahmenlehrplaene/ [20.03.2017].
- ↑ Seilnacht, T.: Naturwissenschaften unterrichten. Didaktik der Naturwissenschaft. Verfügbar unter http://www.seilnacht.com/Chemie/ch_naace.html [26.03.2017].
Siehe auch
Faszination Geysir - der Phasenübergang Sieden am Beispiel eines Naturphänomens