Absorption der Natrium-Spektrallinie
| Absorption der Natrium-Spektrallinie | |
 Experiment zur Absorption der Na-Linie | |
| Kurzbeschreibung | |
|---|---|
| Demonstration der Absorption der Natrium-Spektrallinie und mögliche Berechnung der dazugehörigen Energie oder Wellenlänge. | |
| Kategorien | |
| Atom- und Kernphysik, Spektroskopie | |
| Einordnung in den Lehrplan | |
| Geeignet für: | Sek. II |
| Basiskonzept: | System, Energie, Wechselwirkung |
| Sonstiges | |
| Durchführungsform | Lehrerdemoexperiment |
| Anspruch des Aufbaus | mittel |
| Informationen | |
| Name: | Kai Drobniewski |
| Kontakt: | @ |
| Uni: | Humboldt-Universität zu Berlin |
| Betreuer*in: | Tobias Ludwig |
Unsere alltägliche Wahrnehmung basiert zum großen Teil auf den Eigenschaften von Licht. Als Beispiel wird unsere Farbwahrnehmung durch das Zusammenspiel aus Reflexion und Absorption verschiedener Lichtfrequenzen an Oberflächen beeinflusst. Welche Frequenzen absorbiert werden, ist dabei durch das Material und dessen Eigenschaften bestimmt. Durch dieses Phänomen ist es in der Astronomie möglich, durch Analyse der absorbierten Frequenzlinien des eintreffenden Lichtes zu ermitteln, was z.B. für eine Materiewolke zwischen einer Sonne und unserem Planeten liegt. Der hier aufgeführte Versuch demonstriert genau diesen Fall, bei dem das Licht einer Quelle ein Gas (in diesem Fall Natriumdampf) durchdringt und im aufgespalteten Lichtspektrum den absorbierten Frequenzbereich erkennen lässt.
Inhaltsverzeichnis
Didaktischer Teil
Zur Durchführung des Versuchs ist eine Auseinandersetzung mit den verschiedenen Konzepten zur Lehre der Quantenphysik unerlässlich, da dieses Themengebiet für Schüler und Schülerinnen oft nur schwer zugänglich ist. Die wichtigsten Konzepte werden daher zusammengefasst präsentiert. Die generelle Einordnung des Experiments bezüglich der Lerngruppe, des Ziels und der zu erwarteten Schwierigkeiten kann auf der Unterseite "Einordnung des Experiments" nachgesehen werden.
Unterrichtskonzepte zur Quantenphysik
Zuvor wurde bereits erwähnt, dass die Anwendung und die kritische Auseinandersetzung mit dem Bohr'schen Atommodell Teil dieses Versuchs sein kann.
Da die Anwendung des Bohr'schen Atommodells aber in der Schule kritisch gesehen wird (da es verschiedene, fehlerhafte Schülervorstellungen hervorrufen kann - z.B. das Planetenmodell) und verschiedene Defizite innerhalb des Verständnisses der Quantenphysik bei den Schülern herrschen, wurden verschiedene Konzepte zur Vermittlung der Quantenphysik entwickelt.
Dabei existieren 4 Gruppen von Unterrichtskonzepten (vgl. Quantenphysik in der Schule[1] (2009), S. 19-20):
1. Quantenphysik als Grundlage für die moderne Physik (z.B. Bremer Konzept)
2. Quantenphysik als Grundlage für technologische Anwendungen (z.B. "Visual Quantum Mechanics")
3. Betonung des quantenmechanischen Formalismus und dessen Anwendung (z.B. quantitativer Aufbaukurs des Münchener Konzepts)
4. Deutungsfragen und philosophische Betrachtung der Quantenphysik (z.B. qualitativer Basiskurs des Münchener Konzepts)
Einige der Konzepte sollen nun im folgenden vorgestellt (vgl. Quantenphysik in der Schule[2] (2009), S. 20-29 und Physikdidaktik - Theorie und Praxis[3] (2009)) und anschließend gewertet werden.
Bremer Konzept
Beim Bremer Konzept (Niedderer, 1992) bildet die Schrödinger-Gleichung die Grundlage. Mithilfe von Modellbildungssystemen werden dabei die Lösungen der eindimensionalen Schrödinger-Gleichung ermittelt. Durch das Konzept soll das Atommodell nach Schrödinger mit seinen stationären Zuständen und den diskreten Energieniveaus vermittelt werden, wobei aber auch das Bohr'sche Atommodell soweit berücksichtigt wird, wie es von den Schülern selbst eingebracht wird. Dazu wird die Wellenfunktion als Analogie zu einer stehenden Welle eingeführt. Mittels einer computerorientierten Modellbildung können dann z.B. Energie-Eigenwerte berechnet oder die Auswirkungen von Randbedingungen verdeutlicht werden. Anwendungsgebiete sind sowohl das Wasserstoffatom, als auch das Heliumatom und Festkörper. Eigene Vorstellungen der Schüler sollen ebenfalls eingebracht und diskutiert werden, um die Lernprozesse der Schüler zu fördern.
Das Konzept besteht inhaltlich aus aufeinander aufbauenden Grundbausteinen und optionalen Ergänzungsbausteinen.
Grundbaustein 1: Atombau und Spektrallinien
Grundbaustein 2: Stehende Seilwellen und Krümmungsbegriff
Grundbaustein 3: ψ-Funktion und Schrödinger-Gleichung
Grundbaustein 4: Das Wasserstoffatom
Ergänzungsbaustein 4A: experimentelle Bestimmung von Atomradien
Ergänzungsbaustein 4B: Franck-Hertz-Versuch
Ergänzungsbaustein 4C: Modellierung wasserstoffähnlicher Ionen
Ergänzungsbaustein 4D: nicht radialsymmetrische Zustände, Pauli-Prinzip
Grundbaustein 5: Das Heliumatom
Ergänzungsbaustein 5A: Modellierung weiterer höherer Atome
Ergänzungsbaustein 5B: Röntgenstrahlung
Grundbaustein 6: Das H2++-Molekül
Grundbaustein 7: ψ-Funktion und Festkörper
Ergänzungsbaustein 1A: Quantengehege
Das Konzept wurde in mehreren Studien untersucht. Dabei zeigte sich eine Verbesserung des Verständnisses der grundlegenden quantenmechanischen Prinzipien (z.B. zeigte der Großteil der Schüler eine quantenmechanische Atomvorstellung), wobei aber nur ein geringer Teil ein Verständnis der Schrödinger-Gleichung und deren Anwendung erkennen ließ.
Münchner Konzept
Das Münchner Unterrichtskonzept (Müller u. Wiesener, 2002) setzt sich aus dem qualitativen Basiskurs und dem quantitativen Aufbaukurs zusammen, die jweils unterschiedliche Schwerpunkte und Ziele haben.
quantitativer Basiskurs:
Dieser widmet sich der Deutung der Quantenphysik, ohne, dass sich die Schüler mit dem quantenmechanischen Formalismus auseinandersetzen müssen. Ziel ist die Vermittlung von zur klassischen Physik unterschiedlichen Aspekten der Quantenphysik, wie die Wahrscheinlichkeitsinterpretation und der quantenmechanische Eigenschaftsbegriff und Messprozess. Im ersten Teil des Basiskurses werden die Photonen behandelt. Der Einstieg erfolgt dabei über den Fotoeffekt, gefolgt vom Mach-Zehnder-Interferometer für die Wahrscheinlichkeitsinterpretation, dem Eigenschaftsbegriff und der Welle-Teilchen Problematik. Im zweiten Teil geht es um die Elektronen, wobei vor allem das Doppelspaltexperiment verwendet wird, um die Wahrscheinlichkeitsinterpretation der Wellenfunktion und den Messprozess zu behandeln.
qualitativer Aufbaukurs:
Der Aufbaukurs ist für Leistungskurse gedacht und soll eine Einführung auf die formalen Strukturen der Quantenmechanik geben (auf einfachem mathematischen Niveau). Beispielsweise wird die im Basiskurs behandelte Wellenfunktion als Gleichung eingeführt und darauf aufbauend der Operator erklärt. Weiterhin werden Eigenwertgleichungen und Schrödinger-Gleichung behandelt. Zum Schluss wird das quantenmechanische Atommodell eingeführt.
Das Konzept wurde durch 5 Kurse überprüft. Es zeigte sich, dass gängige Schülervorstellungen (wie das Planetenmodell eines Atoms) bei den Schülern kaum vorhanden waren. Gegenüber einer Kontrollgruppe von Erstsemester-Studenten der Physik waren auch die quantenmechanischen Konzepte, wie die Heisenbergsche Unschärferelation, signifikant ausgeprägter vorhanden.
Berliner Konzept
Das Berliner Konzept (Fischler u. Lichtfeldt, 1994) soll Alternativen zur Verwendung des Bohr'schen Atommodells und der Verwendung der klassischen Physik zur Erklärung quantenphysikalischer Prozesse liefern. Der wichtigste Aspekt des Konzepts ist dabei auch genau dies, dass Bezüge zur klassischen Physik vermieden werden und das Wasserstoffatom ohne die Anwendung des Bohr'schen Atommodells behandelt wird. Außerdem sollen dualistische Formulierung mithilfe der statischen Deutung umgangen werden. Die inhaltliche Strukturierung sieht wie folgt aus:
1. Vorfürhung der Elektronenbeugung und experimentelle Herleitung der De-Groglie-Beziehung
2. Demonstration des Doppelspaltversuchs mit Hilfe eines Trickfilms über den Versuch von Jönsson und Behandlung dessen Veröffentlichung
3. Behandlung der Heisenbergschen Unschärferelation
4. Einführung der Energiequantelung für den unendlich tiefen Potentialtopf, danach für das Wasserstoff-Atom
5. Durchführung des Franck-Hertz-Versuchs (Bestätigung der Energiequantelung)
6. Zeigen verschiedener Eigenschaften von Photonen, wie Energie, Impuls und stochastischer Charakter (Fotoeffekt, Taylor-Experiment und Compton-Effekt)
7. Betrachtung von Deutungsproblemen der Quantenphysik
In einer Evaluierungsstudie konnte ermittelt werden, dass 20% der Schüler korrekte Vorstellungen und 47% zumindest akzeptable Vorstellungen entwickelt haben.
"Visual Quantum Mechanics"-Konzept
Das Konzept (Zollman, 2002) soll Schüler oder Studenten unterstützen, die nicht auf weitgehende Mathematikkenntnisse und Kenntnisse in der modernen Physik zurückgreifen können. Als Grundlage werden die Beobachtungen von einem Experiment analysiert und erklärt. Darauf folgt dann die Vermittlung der benötigten theoretischen Grundlagen. Durch eigenständiges Arbeiten der Schüler an experimentellen Anwendungen sollen dann ihre Kenntnisse vertieft werden. Bei dem Konzept sollen vor allem Visualisierungstechniken verwendet werden, anstelle der Voraussetzung von tiefgehenden mathematischen Kenntnissen. Außerdem sollen die Schüler einen eigenständigen praktischen Umgang mit den Lerninhalten pflegen und selbsständig Erklärungsmöglichkeiten entwickeln. Die Quantenphysikalischen Prinzipien werden durch ihre Anwendung in modernen Technologien erläutert.
In einer breit angelegten Studie konnte gezeigt werden, dass sowohl Schüler mit geringen naturwissenschaftlichen Kenntnissen vom "Visual Quantum Mechanics" Originalkurs profitieren, als auch welche mit breiterem Grundwissen.
Wertung der Konzepte
Ob das Bohr'sche Atommodell im Rahmen des Schulunterrichts verwendet werden sollte, ist umstritten. Oft ruft die Anwendung fehlerhafte Schülervorstellungen (wie das Planetenmodell) hervor. Das Berliner Konzept geht diesem Fall am stärksten entgegen, zeigt aber in der Evaluierung nur relativ schlechte Ergebnisse. Beim Bremer Konzept geht man nur auf Bohr ein, wenn er von den Schülern eingebracht wird. Die Testergebnisse dieses Konzepts scheinen besser zu sein. Die besten Ergebnisse (wenn man die Spezialisierung des "Visual Quantum Mechanics"-Konzepts auf leistungsschwache Schüler weglässt) kann anscheinend das Münchner Konzept vorweisen, dass sich vor allem auf die qualitative Betrachtung konzentriert. Ich selbst habe in meiner Schulzeit eine Mischung aller drei Konzepte (vorwiegend Münchener) erlebt und damit gut Erfahrungen gemacht. So scheint es mir ebenfalls wichtig, dass auf eine qualitative Betrachtung geachtet wird. Die Anwendung der Schrödinger-Gleichung halte ich dabei für zu kompliziert.
Allerdings vertrete ich auch die Meinung, dass das Bohr'sche Atommodell thematisiert werden sollte. Dieses Modell bildet die Grundlage bei gesellschaftlichen Diskussionen in diesem Themengebiet und wird durch die meisten Abbildungen im öffentlichen Leben verteten (Planetenmodell). Nur über eine Thematisierung kann man die Grenzen des Modells aufzeigen und Alternativen besprechen, um die Modellkompetenz der Schüler zu verbessern. Ziel sollte meiner Meinung nach nicht das Ausmerzen des Bohr'schen Atommodells sein, sondern die Fähigkeit bei Schülern zu entwickeln, zwischen einem Modell und einem anderen (z.B. Bohr'sches und quantenmechanisches Atommodell) wechseln zu können, um jedes je nach Ausgangslage anwenden zu können.
Der Versuch zur Absorption der Natrium-Spektrallinie ist am ehestem dem Münchener Konzept mit der qualitativen Betrachtung zuzuschreiben, vor allem, wenn man die Variante des Experiments wählt, bei dem die Emissionslinie üder der Absorptionslinie abgebildet wird. Dieses Konzept eignet sich auch, um trotz Verwendung des Bohr'schen Atommodells eine Entwicklung der Planetenmodell-Vorstellung entgegenzuwirken. Dies ist bei diesem Versuch gerade wichtig, da man hier die Absorption und Emission (mit den dazugehörigen Frequenzen / Energiewerten) sehr gut mit dem Bohr'schen Atommodell erklären kann.
Versuchsanleitung
benötigte Materialien
1x optische Bank, 1m
6x Standfüße (Leybold 460352)
1x Schirm
1x Experimentierleuchte (Leybold 45064)
2x Kabelverbindung für Lampe
1x PHYWE Stelltrafo (siehe Abb. 1)
1x Stromkabel für den Trafo
1x verstellbarer Spalt
2x Linse, f = +100 mm
1x Gitterhalterung
1x optisches Gitter (600 Lines/mm)
2x höhenverstellbare Experimentiertische
1x Brett
1x Natrium-Fluoreszenzröhre
1x Heizofen für Natrium-Fluoreszenzröhre (NEVA Type 6753)
1x Blatt Papier (am besten Millimeter)
1x Stift
gegebenenfalls 1x Lineal
Versuchsaufbau
Im Folgenden werden alle Positionsangaben der Standfüße ausgehend von der vorderen Seite des Standfußes gemacht.
Zuerst muss die optische Bank auf einer geeigneten Fläche stabil aufgestellt werden. Danach wird die Experimentierleuchte in einem Standfuß gesteckt und befestigt. Dieser wird dann auf der Bank montiert. Die Lichtquelle der Leuchte sollte weit nach hinten gestellt werden. Die Experimentierleuchte muss nun über zwei Kabelverbindungen an den Stromanschlüssen mit den Anschlüssen des Stelltrafo (0…25V, 12 A) verbunden werden (Achtung: Der Trafo sollte vorerst noch ausgeschaltet sein).
Der Regler des Trafo wird auf 12 V gestellt. Vor die Experimentierleuchte muss nun ein auf einem Standfuß gesteckter, verstellbarer Spalt (Breite: ca. 0,18) platziert werden. Dahinter wird, ebenfalls auf einem Standfuß, eine der beiden Linsen
(f = 100 mm) montiert, sodass der Spalt genau im Brennpunkt der Linse liegt. Nun folgen die beiden höhenverstellbaren Experimentiertische, auf denen ein Brett gelegt und darauf in der Mitte der Heizofen (Heizung aus!) mit der Natrium-Fluoreszenzröhre platziert wird. Die zweite Linse (ebenfalls f = 100 mm) wird auf einem Standfuß dahinter platziert.
Die Fluoreszenzröhre wird mit dem Heizofen nun so gestellt, dass sie genau im Brennpunkt beider Linsen steht. Hinter die Linse kommt noch eine auf einem Standfuß gesteckte Gitterhalterung mit dem dazugehörigen Gitter (600 Lines/mm), ebenfalls wieder im Brennpunkt. Im Demonstrationsversuch wurde das Gitter näher zur Linse gebracht, um die sehr dünne, schwarze Absorptionslinie besser erkennen zu können. Schließlich wird in einiger Entfernung noch der Schirm angebracht (bei 143,8 cm). Zum Schluss werden Trafo und Heizofen mittels Stromkabel mit dem Stromnetz verbunden. Wichtig ist, dass alle optischen Elemente auf einer optischen Linie liegen.
Der Aufbau ist in Abbildung 2 dargestellt.
Versuchsdurchführung
Prinzipiell sind mit dem Versuchsaufbau zwei verschiedene Versuche durchführbar: einer zur Absorption von Licht und einer zur Emission von Licht. Beide Versuche wurden auch durchgeführt und sollen hier getrennt betrachtet werden.
Versuch zur Absorption
Vor Beginn des Versuchs wird der Regler des Heizofens auf 250°C gestellt. Direkt danach kann der Trafo angeschaltet werden. Danach erfolgt erst einmal eine Wartezeit, in der sich der Heizofen auf die gewünschte Temperatur erhitzen und das Natrium allmählich verdampfen kann. Außerdem muss die Experimentierleuchte über eine Einlaufzeit auf eine Betriebstemperatur gebracht werden, um ein möglichst klares Spektrum zu gewährleisten. Nach einer Abdunkelung des Raumes kann man das Lichtspektrum mit der Absorptionslinie erkennen. Für eine qualitative Analyse besteht nun die Möglichkeit, den Heizofen aus dem Strahlengang zu entfernen, um zu zeigen, wie die Absorptionslinie verschwindet. Für die quantitative Untersuchung hält man ein Blatt Papier (leer oder Millimeterpapier) an den Schirm (oder befestigt es mit Klebeband) und markiert das Maximum 0. Ordnung (heller weißer Strich) und die Absorptionslinien auf beiden Seiten. Anschließend kann dann der Abstand zwischen den Markierungen mit dem Lineal (oder über das Millimeterpapier) vermessen und daraus die Wellenlänge berechnet werden.
Versuch zur Emission
Zusätzlich zur Absorption der Natrium-Spektrallinie kann auch noch die Emissionslinie gezeigt werden. Dabei gibt es die qualitative Möglichkeit (siehe alternative Möglichkeiten) und die quantitative, die hier vorgestellt wird, da sie zur Demonstration verwendet wurde. Dazu kann man das Licht einer Natriumdampflampe (über eine Universaldrossel - Leybold 45130 - am Stromnetz angeschlossen) antselle der Experimentierleuchte verwenden. Außerdem muss der Ofen aus der Mitte entfernt werden. Nach Inbetriebnahme zeigt das resultierende Spektrum die Emissionslinien von Natrium. Der Abstand der Emissionslinien zum Hauptmaximum kann analog zur Versuchsdurchführung der Absorption ermittelt werden.
Ergebnisse
Bei der Betrachtung des Absorptionsspektrums sollte man eine dünne, schwarze Linie im gelben Bereich erkennen können (vergl. Abb. 3). Möglicherweise kann man auch ein schwaches, gelblich-orangenes Leuchten in der Natrium-Fluoreszenzröhre erkennen.
Beim Emissionsspektrum erhält man hingegen einfache, orangene Linien (vergl. Abb. 4).
Für die Demonstration wurden an unabhängigen Tagen verschiedene Messungen zum Abstand der Absorptions- und Emissionslinien von Natrium bei gleichbleibender Distanz Gitter-Schirm (da = (18,30 ± 0,06) cm, bzw. de = (20,20 ± 0,06) cm) durchgeführt, wobei innerhalb der Messungenauigkeit immer die gleichen Werte ermittelt wurden. Die Unsicherheit ergibt sich dabei aus der Produktionsunsicherheit des Lineals (100 µm + 10-3·L, vgl. Einführungsskript Grundpraktikum[4] (2007), S. 17) und der Ablesegenauigkeit (0,5 mm). Für eine ordentliche Verifizierung des Wertes müsste man den Versuch vor einer Messung immer ab- und wieder neuaufbauen.
|
|
Auswertung
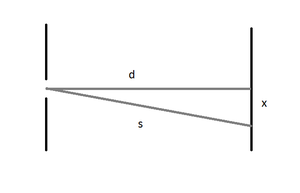
Über die geometrische Beziehung in einem rechtwinkligen Dreieck (vergleiche Abb. 5) und der Gittergleichung (vgl. Demtröder 2[5] (2006)) ergibt sich die Formel:
Dabei ist k die Ordnung, die Wellenlänge des Lichts und g die Gitterkonstante. Die Strecke s kann man über den Satz des Pythagoras berechnen.
Über diese Beziehung kann mithilfe der Mittelwerte der ober ermittelten Werte nun die Wellenlänge der Spektrallinien berechnet werden. Unter Berücksichtigung des Fehlerfortpflanzungsgesetzes ergibt sich:
| Linie | Abstand x [cm] | Wellenlänge [nm] |
|---|---|---|
| Emission | 7,63 ± 0,04 | 588,6 ± 3,5 |
| Absorption | 6,90 ± 0,04 | 588,0 ± 3,9 |
Die ermittelten Werte stimmen innerhalb ihrer Unsicherheiten miteinander und mit den Referenzwerten für das Natrium-Dublett 588,9950 nm und 589,5924 nm überein (vgl. Grundpraktikum Elektrodynamik und Optik[6] (2005), S. 57), wobei wir nur eine Linie erhalten, da die Auflösung des Versuchs für beide Linien nicht ausreicht. Somit kann gezeigt werden, dass das Emissions- und Absorptionsspektrum von Natrium übereinstimmt.
Zu der Messunsicherheit des Lineals kommt noch die Unsicherheit bei der Übertragung der Spektrallinie auf das Blatt (im Dunklen) und die Unsicherheit aufgrund der Ausdehnung der Emissionslinien und der Linie des Hauptmaximums dazu.
Sicherheitshinweise
Bei dem Versuch ist darauf zu achten, dass man den Heizofen, nachdem dieser angeschaltet wurde, nur noch am dafür vorgesehenen Griff anfasst und auch dann nur mit Vorsicht (z.B. Schutzhandschuhe), da der Ofen eine Temperatur von 250°C erreicht. Außerdem sollte man wegen der starken Lichtintensität nicht direkt in die Experimentierleuchte schauen.
alternative Möglichkeiten
qualitatives Emissionsspektrum einer Natriumdampflampe
Alternativ kann man das Emissionsspektrum einer Natriumdampflampe (vergl. Abb. 4) auch über das Absorptionsspektrum legen. Entweder zeitlich verzögert, indem man die Positionen der Absorptionslinien und des Hauptmaximums auf dem Schirm markiert, dann den Heizofen entfernt und die Experimentierleuchte durch die Natriumdampflampe ersetzt. Dabei ist aber eine weitere Justierung nötig. Liegt danach jedoch das Hauptmaximum auf dem ursprünglichen und die Emissionslinien auf den ehemaligen Absorptionslinien, wäre dies ein optischer Nachweis, dass es sich um die gleichen Wellenlängen handelt (bei gleichem Gitter-Schirm-Abstand). Eleganter wäre aber die Methode, wenn man das Emissionsspektrum der Natriumdampflampe mittels eines zusätzlichen Aufbaus direkt auf das Absorptionsspektrum projiziert. Dafür benötigt man die Natriumdampflampe mit einem gleich großen Spalt und einem gleichen Gitter, wie bei der Absorption, sowie einenen halbdurchlässigen Spiegel, über den das Bild dann über das Absorptionsspektrum gelegt wird.
Auslöschung des Spektrums einer Natriumdampflampe
Eine andere Alternative zum optischen Nachweis, dass Emissions- und Absorptionsspektrum gleich sind, erreicht man, wenn man statt der Experimentierleuchte eine Natriumdampflampe verwendet und das Emissionsspektrum durch den entstehenden Natriumdampf bei eingeschaltetem Heizofen verschwinden lässt (vgl. Physikalische Schulexperimente Band 3[7] (2002), S. 292-294).
Literatur
- ↑ Burkard, U. (2009): Quantenphysik in der Schule: Bestandsaufnahme, Perspektiven und Weiterentwicklungsmöglichkeiten durch die Implementation eines Medienservers; Logo Verlag Berlin GmbH, Berlin
- ↑ Burkard, U. (2009): Quantenphysik in der Schule: Bestandsaufnahme, Perspektiven und Weiterentwicklungsmöglichkeiten durch die Implementation eines Medienservers; Logo Verlag Berlin GmbH, Berlin
- ↑ Kircher, E. (2009): Physikdidaktik - Theorie und Praxis; 2. Auflage, Springer Verlag, Berlin
- ↑ Müller, U. (2007): Physikalisches Grundpraktikum: Einführung in die Messung, Auswertung und Darstellung experimenteller Egebnisse in der Physik; Humboldt-Universität zu Berlin
- ↑ Demtröder, W. (2006): Experimentalphysik 2 - Elektrizität und Optik; 4. Auflage, Springer-Verlag, Kaiserslautern
- ↑ Müller, U. (2005): Physikalisches Grundpraktikum: Elektrodynamik und Optik; Humboldt-Universität zu Berlin
- ↑ Wilke, H.-J. (2002): Physikalische Schulexperimente: Experimente für die Sekundarstufe II - Band 3; 1. Auflage, Volk und Wissen Verlag, Berlin